Học bảng tuần hoàn hóa học là một thách thức đối với nhiều học sinh đặc biệt là các bạn học sinh vừa mới bắt đầu lên lớp 8. Sau đây bài viết này của Hoc2k.vn sẽ giúp bạn hiểu rõ được những thành phần cấu thành bảng và cách sử dụng nó để hiểu về tính chất và quy luật của các nguyên tố. Đồng thời chia sẻ mẹo giúp bạn học, đọc bảng tuần hoàn hóa học một cách dễ hiểu và nhớ nhanh nhất.
Bảng tuần hoàn hóa học là gì?
Bảng tuần hoàn hóa học có tên tiếng anh là Periodic table và cũng là một công cụ quan trọng trong lĩnh vực hóa học, giúp tổ chức và phân loại các nguyên tố hóa học theo cấu trúc và tính chất của chúng. Được sử dụng rộng rãi trong các nghiên cứu và ứng dụng thực tế, Bảng tuần hoàn hóa học cung cấp một cách tiện lợi để nắm bắt kiến thức về các nguyên tố và tương tác giữa chúng.
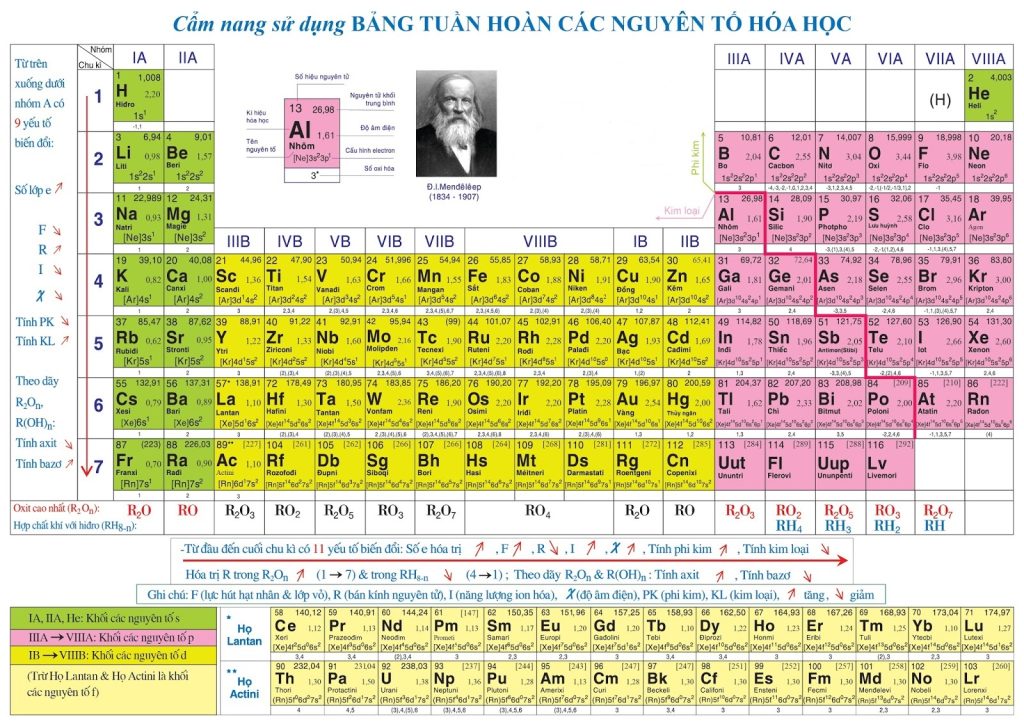
Lịch sử phát triển của bảng tuần hoàn các nguyên tố hóa học
Trong thời kỳ Trung cổ, con người đã nhận ra sự tồn tại của những nguyên tố như vàng, bạc, đồng, chỉ, sắt, thủy ngân và lưu huỳnh. Vào năm 1649, phát hiện ra thêm một nguyên tố mới là photpho. Tuy nhiên, cho đến năm 1869, chỉ có 63 nguyên tố được phát hiện.

Vào năm 1862, J. Dobereiner đã nhận thấy rằng khối lượng nguyên tử của nguyên tố stronti nằm giữa khối lượng nguyên tử của hai nguyên tố khác là bari và canxi. Ba nguyên tố này có tính chất tương tự. Sau đó, các nhà khoa học đã tìm ra những bộ ba khác mà cũng tuân theo quy luật tương tự.
Năm 1862, nhà địa chất người Pháp De Chancourtois đã sắp xếp các nguyên tố hóa học theo thứ tự tăng dần của khối lượng nguyên tử trên một dải giấy (dải giấy này được cuốn quanh một trụ như lò xo xoắn). Ông nhận thấy rằng tính chất của các nguyên tố cũng tương tự như tính chất của các con số, và những tính chất đó lặp lại sau mỗi 7 nguyên tố.
Năm 1864, John Newlands, một nhà hóa học người Anh, đã phát hiện ra quy luật: Mỗi nguyên tố hóa học có tính chất tương tự như nguyên tố thứ 8 trong khi được sắp xếp theo thứ tự tăng dần của khối lượng nguyên tử.
Vào năm 1860, nhà bác học người Nga Mendeleev đã đề xuất ý tưởng xây dựng một bảng tuần hoàn các nguyên tố hóa học. Ông đã công bố bảng tuần hoàn đầu tiên của mình vào năm 1869.
Năm 1870, nhà khoa học người Đức Lothar Mayer, một người nghiên cứu độc lập, đã tạo ra một bảng tuần hoàn các nguyên tố hóa học tương tự như bảng của Mendeleev.
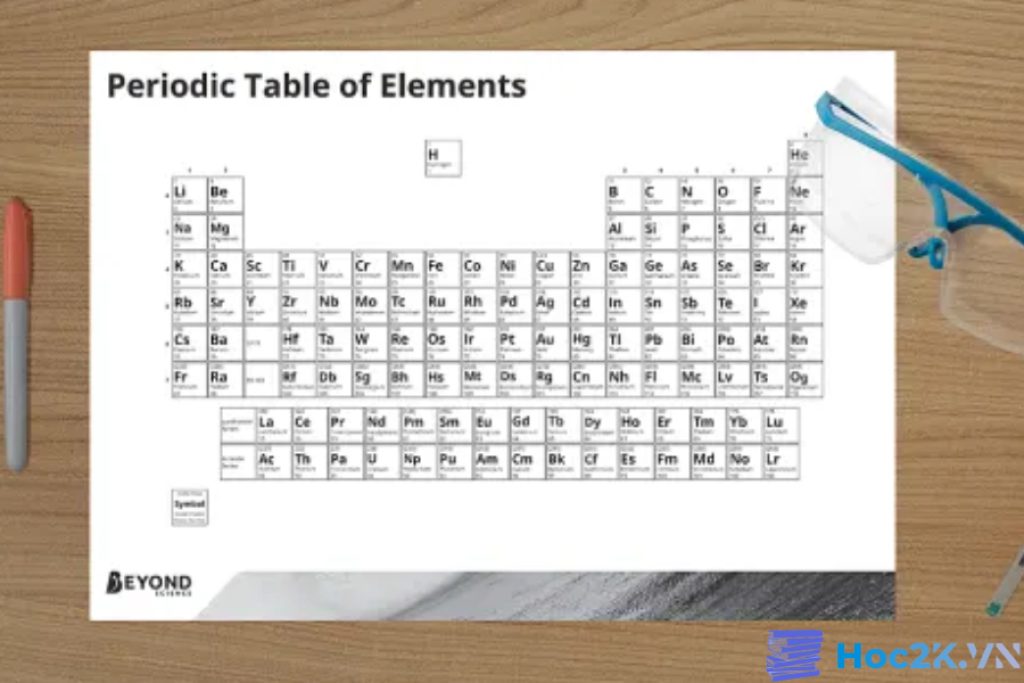
Cấu trúc của bảng tuần hoàn hóa học
Cấu trúc của bảng tuần hoàn hóa học được phân thành ba phần chính gồm các hàng ngang (chu kỳ), các cột dọc (nhóm) và một khu vực đặc biệt chứa các nguyên tố hiếm (hay còn gọi là nguyên tố chuyển tiếp). Mỗi phần đóng vai trò quan trọng trong việc tổ chức và phân loại các nguyên tố hóa học.
Chu kỳ
Chu kỳ trong bảng tuần hoàn hóa học là một khái niệm quan trọng để hiểu sự sắp xếp và sự biến đổi của các nguyên tố hóa học. Nhưng trước tiên, chúng ta cần hiểu rõ về khái niệm chu kỳ trong ngữ cảnh này.
Mỗi chu kỳ trong bảng tuần hoàn là một hàng ngang trên bảng. Hiện nay, bảng tuần hoàn gồm 7 chu kỳ chính, được đánh số từ 1 đến 7 theo chữ số La Mã. Chu kỳ đầu tiên bắt đầu từ nguyên tố hidro (H) và kết thúc ở nguyên tố franci (Fr), còn các chu kỳ tiếp theo lần lượt tiếp tục với các nguyên tố tiếp theo.
Các chu kỳ trong bảng tuần hoàn hóa học có ý nghĩa quan trọng về cấu trúc electron của các nguyên tử. Mỗi chu kỳ tương ứng với một lớp electron trong cấu trúc của nguyên tử và chứa một số lượng nguyên tố khác nhau
Chu kỳ đầu tiên trong bảng tuần hoàn hóa học bao gồm hai nguyên tố, đó là hidro (H) và helium (He). Trong chu kỳ này, các nguyên tố có một lớp electron ngoại cùng trong cấu trúc nguyên tử của chúng. Điện tích hạt nhân của hidro là 1+, trong khi helium có điện tích hạt nhân là 2+.
Chu kỳ thứ hai trong bảng tuần hoàn hóa học bao gồm tám nguyên tố từ lithium (Li) đến neon (Ne). Trong chu kỳ này, các nguyên tố có hai lớp electron trong cấu trúc nguyên tử của chúng. Điện tích hạt nhân tăng dần từ lithium là 3+ cho đến neon là 10+.
Chu kỳ thứ ba trong bảng tuần hoàn hóa học bao gồm tám nguyên tố từ natri (Na) đến argon (Ar). Trong chu kỳ này, các nguyên tố có ba lớp electron trong cấu trúc nguyên tử của chúng. Điện tích hạt nhân tăng dần từ natri là 11+ cho đến argon là 18+.
Chu kỳ thứ tư và chu kỳ thứ năm trong bảng tuần hoàn hóa học đều bao gồm 18 nguyên tố. Chu kỳ này bắt đầu với một kim loại kiềm potassium (K) có điện tích hạt nhân là 19+, và kết thúc với hai khí hiếm là krypton (Kr) có điện tích hạt nhân là 36+ và xenon (Xe) có điện tích hạt nhân là 54+.
Chu kỳ thứ sáu trong bảng tuần hoàn hóa học gồm 32 nguyên tố. Được bắt đầu từ kim loại kiềm cesium (Cs) có điện tích hạt nhân là 55+ và kết thúc với khí hiếm radon (Rn) có điện tích hạt nhân là 86+.
Chu kỳ thứ bảy trong bảng tuần hoàn hóa học hiện tại vẫn chưa hoàn thành.
Các chu kỳ cũng có thể giúp chúng ta nhận biết các xu hướng và quy luật trong tính chất hóa học của các nguyên tố. Các nguyên tố cùng một chu kỳ thường có cùng các lớp electron ngoại cùng và thường có những đặc điểm hóa học tương tự. Đồng thời, qua việc xem xét các tính chất hóa học của các nguyên tố theo từng chu kỳ, chúng ta có thể nhận thấy các xu hướng và sự biến đổi theo một cách có hệ thống.
Nhóm
Nhóm trong bảng tuần hoàn hóa học là một khái niệm quan trọng để hiểu sự phân loại và sự tương đồng giữa các nguyên tố hóa học. Nhóm còn được gọi là cột dọc trên bảng tuần hoàn và bao gồm các nguyên tố có tính chất hóa học tương tự.
Hiện nay, bảng tuần hoàn hóa học được chia thành 18 nhóm chính. Mỗi nhóm được đánh số từ 1 đến 18. Các nhóm này giúp chúng ta nhận biết các xu hướng và đặc điểm chung trong tính chất hóa học của các nguyên tố.
Các nguyên tố trong cùng một nhóm thường có cùng số lượng electron ngoại cùng. Điều này có ý nghĩa rằng chúng có cấu trúc electron tương tự và thường có tính chất hóa học tương đồng. Ví dụ, nguyên tố natri (Na) và Kali (K) đều thuộc vào nhóm 1, có cùng một electron ngoại cùng và có tính chất hóa học tương tự trong việc tạo phản ứng với nước để tạo thành các hợp chất kiềm.
Ngoài ra, các nhóm trong bảng tuần hoàn cũng có thể giúp chúng ta dự đoán và phân tích các tính chất của các nguyên tố chưa biết. Chẳng hạn, nếu chúng ta đã biết tính chất của một nguyên tố trong một nhóm nhất định, chúng ta có thể suy ra rằng các nguyên tố trong cùng nhóm khác cũng có khả năng có tính chất tương tự.
Ô nguyên tố
Ô nguyên tố trong bảng tuần hoàn hóa học chứa các thông tin quan trọng về nguyên tử của các nguyên tố hóa học. Mỗi ô nguyên tố cung cấp số hiệu nguyên tử, ký hiệu hóa học, tên nguyên tố và nguyên tử khối của nguyên tố tương ứng.
Ô nguyên tố trong bảng tuần hoàn hóa học có những vị trí trống trên bảng, chưa có nguyên tố nào được xác định. Các ô nguyên tố này chưa được điền với nguyên tố cụ thể nào, vì chúng có cấu trúc electron phức tạp và tính chất hóa học đặc biệt. Chính vì vậy, nghiên cứu và xác định các nguyên tố trong ô này là một thách thức lớn trong lĩnh vực hóa học.
Chi tiết của một ô nguyên tố trong bảng tuần hoàn nguyên tố hóa học
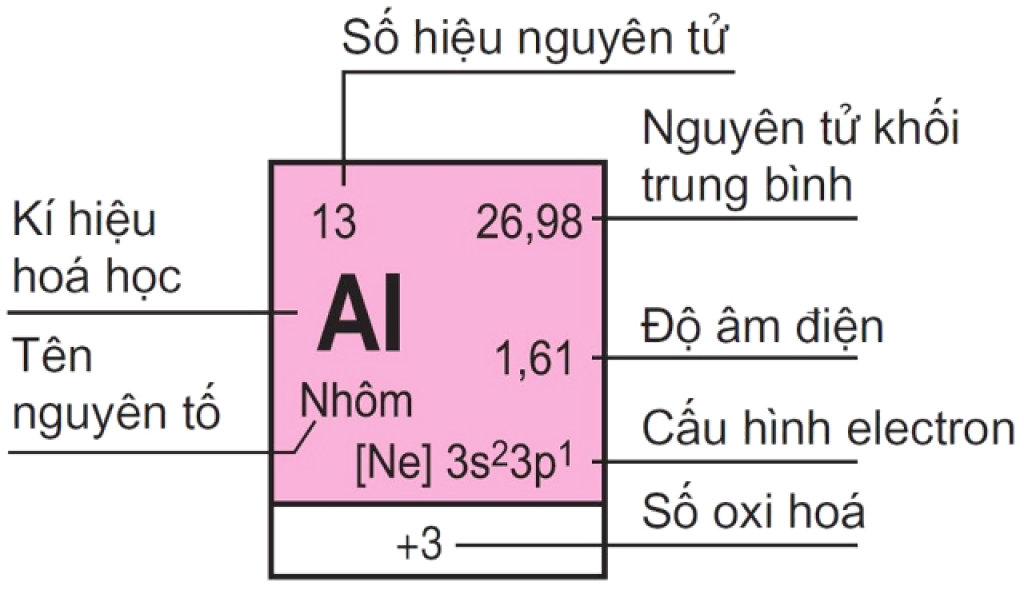
Để đọc, học bảng tuần hoàn hóa học một cách dễ dàng và chính xác trong môn hóa thì cần phải biết đến một số thuật ngữ sau đây:
- Số hiệu nguyên tử còn được gọi là số proton, là đại diện cho số proton có trong hạt nhân của một nguyên tử hóa học. Số hiệu nguyên tử cũng chỉ ra số điện tích dương của hạt nhân. Nó có giá trị bằng số electron trong một nguyên tử trung hòa điện. Quan trọng nhất, số hiệu nguyên tử giúp xác định một nguyên tố hóa học duy nhất và không trùng lặp.
- Nguyên tử khối trung bình của các nguyên tố hóa học được xác định dựa trên việc chúng thường là hỗn hợp của nhiều đồng vị khác nhau, với tỉ lệ phần trăm của mỗi đồng vị xác định. Do đó, để tính toán nguyên tử khối của các nguyên tố này, ta sử dụng nguyên tử khối trung bình của hỗn hợp đồng vị, dựa trên tỉ lệ phần trăm của từng nguyên tử tương ứng.
- Cấu hình electron là biểu thị cho việc phân bố của các electron trong các trạng thái năng lượng khác nhau trong lớp vỏ của nguyên tử hoặc trong các vị trí mà chúng có mặt.
- Độ âm điện là khả năng của một nguyên tử hút electron trong quá trình tạo liên kết hóa học. Để hiểu rõ hơn, hãy nhớ rằng độ âm điện tăng theo sự tăng tính phi kim của nguyên tố. Nghĩa là, khi độ âm điện của một nguyên tử càng cao, tính phi kim của nó càng mạnh, và ngược lại.
- Số oxi hóa là số được gán cho một nguyên tử hoặc một nhóm nguyên tử. Với con số này, học sinh có thể tính được số electron trao đổi trong quá trình tham gia phản ứng.
- Tên nguyên tố được dùng để định danh một loại nguyên tử duy nhất, và được phân biệt dựa trên số hiệu nguyên tử.
- Ký hiệu hóa học là tên viết tắt của nguyên tố hóa học, bao gồm một hoặc hai chữ cái Latinh. Chữ cái đầu tiên thường được viết hoa.
Nguyên tố chuyển tiếp
Nguyên tố chuyển tiếp là một nhóm nguyên tố hóa học nằm ở trung tâm của bảng tuần hoàn. Chúng được gọi là “chuyển tiếp” vì chúng có khả năng chuyển các electron trong quá trình tạo liên kết hóa học.
Các nguyên tố chuyển tiếp nằm trong các hàng từ hàng 4 đến hàng 7 của bảng tuần hoàn, bắt đầu từ scandi (Sc) đến canxi (Ca) và từ titan (Ti) đến niken (Ni). Họ cũng bao gồm các nguyên tố từ đồng (Cu) đến kết (Zn) trong hàng 4 và từ bạc (Ag) đến cadimi (Cd) trong hàng 5.
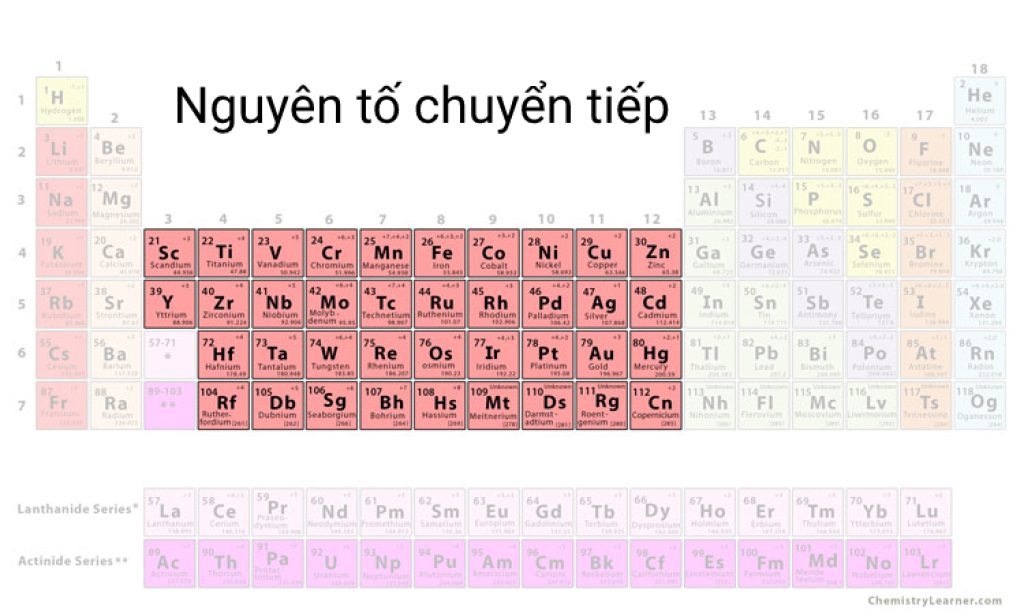
Một đặc điểm quan trọng của nguyên tố chuyển tiếp là chúng có các cấu hình electron gần như đầy đủ trong lớp vỏ thứ hai của họ. Điều này có nghĩa là các electron bên ngoài cùng (electron valence) của chúng có thể di chuyển một cách dễ dàng để tạo ra các liên kết hóa học.
Nguyên tố chuyển tiếp thường có tính chất kim loại và tham gia vào nhiều phản ứng hóa học quan trọng. Chúng có thể tạo ra các ion dương có nhiều cấp độ điện tích khác nhau và thường tạo thành hợp chất phức với các phân tử khác.
Ví dụ, sắt (Fe) là một nguyên tố chuyển tiếp phổ biến, có khả năng tạo ra các ion Fe2+ và Fe3+ trong quá trình phản ứng. Các ion này có thể tham gia vào nhiều quá trình quan trọng, như trong quá trình oxy hóa khử và trong các hệ thống sinh học như hemoglobin trong máu.
Nguyên tố chuyển tiếp là một nhóm quan trọng trong bảng tuần hoàn hóa học, có tính chất kim loại và có khả năng chuyển electron để tham gia vào các phản ứng hóa học quan trọng trong tự nhiên và các ứng dụng công nghiệp.
4 Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn hóa học
Nguyên tắc sắp xếp theo số nguyên tử tăng dần: Các nguyên tố được sắp xếp dựa trên số hiệu nguyên tử tăng dần từ trái qua phải và từ trên xuống dưới trên bảng tuần hoàn. Điều này tạo ra một thứ tự tăng dần của các nguyên tố theo số nguyên tử.
Nguyên tắc sắp xếp theo cấu hình electron: Các nguyên tố có cùng cấu hình electron trong cùng một lớp vỏ nguyên tử được xếp cùng một hàng ngang trên bảng tuần hoàn. Điều này tạo ra sự tương tự trong tính chất hóa học của các nguyên tố trong cùng một hàng.
Nguyên tắc sắp xếp theo tính chất tăng dần: Các nguyên tố trong cùng một nhóm (cột) trên bảng tuần hoàn có tính chất hóa học tương tự. Các nhóm được sắp xếp dọc theo cột và các nguyên tố trong cùng một nhóm có cấu hình electron tương tự và có xu hướng có tính chất hóa học tương tự.
Nguyên tắc sắp xếp theo loại nguyên tử: Các nguyên tố trong bảng tuần hoàn được chia thành các nhóm dựa trên các tính chất chung của nguyên tử, như kim loại, phi kim và bán dẫn. Các nhóm này tạo ra các mô hình và xu hướng trong tính chất hóa học của các nguyên tố.
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn giúp tạo ra một hệ thống tổ chức và logic, cho phép người học hiểu và nhớ dễ dàng các thông tin về các nguyên tố hóa học.
Mẹo học thuộc lòng bảng tuần hoàn hóa học
Để học bảng tuần hoàn hóa học hiệu quả và dễ dàng nhớ được các thông tin về các nguyên tố hóa học thì hãy áp dụng những mẹo sau đây:
Nhóm IA: Hai, Li, Nào, Không, Rót, Cà, Fê (H,Li,Na,K,Rb,Cs,Fr)
Nhóm IIA: Banh, Miệng, Cá, Sấu, Bé, Răng (Be,Mg,Ca,Sr,Ba,Ra)
Nhóm IlIA: Bố, Ai, Gáy, Inh, Tai (B,Al,Ga,In,Tl)
Nhóm IV: Chú, Sỉ, Gọi em, Sang nhắm, Phở bò (C,Si,Ge,Sn,Pb)
Nhóm V: Nhà, Phương, Ăn, Sống, Bí (N,P,As,Sb,Bi)
Nhóm VI: Ông, Say, Sỉn, Té, Pò (O,S,Se,Te,Po)
Nhóm VII: Phải, Chi, Bé, Yêu, Anh (F,CI,Br,I,At)
Nhóm VIll: Hằng, Nga, Ăn, Khúc, Xương, Rồng (He,Ne,Ar,Kr,Xe,Rn)
7 Phương pháp học tốt bảng tuần hoàn lớp 8,9,10
Học theo nhóm: Phân nhóm các nguyên tố trong bảng tuần hoàn theo các đặc điểm chung như kim loại kiềm, kim loại kiềm thổ, halogen, khí hiếm, và nguyên tố chuyển tiếp. Việc này giúp bạn nhận ra các mô hình và sự tương quan giữa các nguyên tố trong cùng một nhóm.

Tìm hiểu cấu trúc: Hiểu cấu trúc của bảng tuần hoàn sẽ giúp bạn nhận ra các mẫu và quy tắc. Hãy tìm hiểu về số hiệu nguyên tử, số oxi hóa, và cấu hình electron của các nguyên tố.
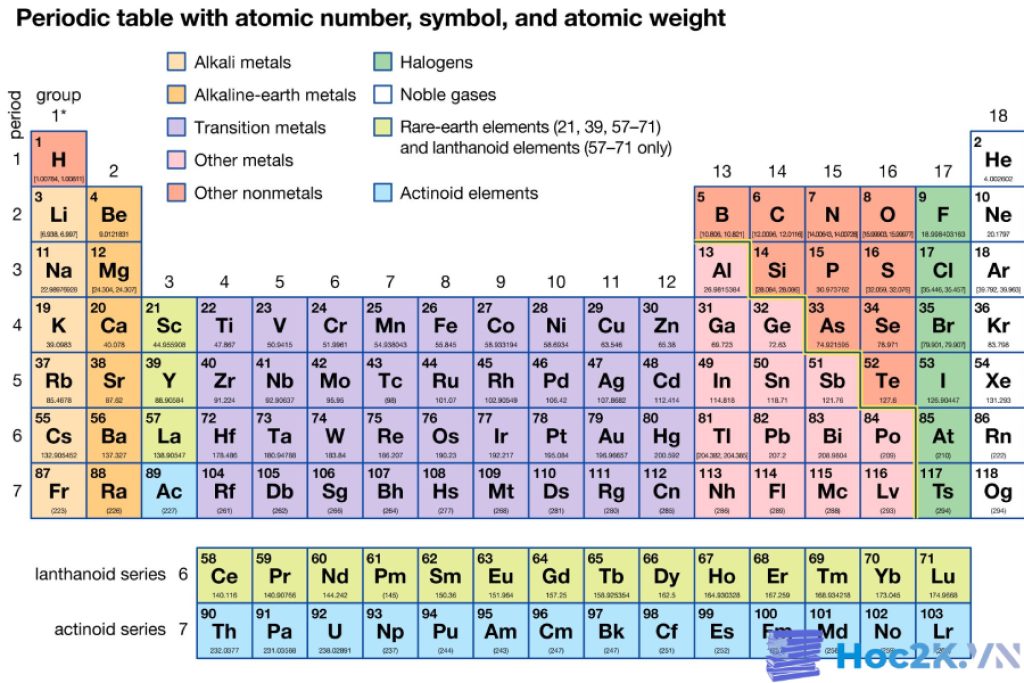
Sử dụng các kỹ thuật học tương tác: Sử dụng bảng tuần hoàn hóa học tương tác, bằng cách tạo ra các flashcard, sử dụng ứng dụng di động, hoặc tham gia các hoạt động trực tuyến để rèn kỹ năng ghi nhớ thông tin về các nguyên tố.
Học bằng việc vận dụng: Thực hành áp dụng kiến thức bằng cách giải các bài tập và làm các ví dụ liên quan đến bảng tuần hoàn. Điều này giúp bạn áp dụng kiến thức và hiểu sâu hơn về các tính chất và mối quan hệ giữa các nguyên tố.
Tạo liên kết và mối quan hệ: Kết nối các thông tin với nhau để tạo ra liên kết và mối quan hệ logic. Ví dụ, tìm hiểu sự tương quan giữa các cột và hàng trong bảng tuần hoàn để nhớ dễ dàng hơn.
Luyện từ vựng: Học các thuật ngữ và từ vựng liên quan đến bảng tuần hoàn để hiểu và sử dụng chính xác các khái niệm trong môn hóa học này.
Sử dụng tài liệu học phù hợp: Sử dụng sách giáo trình, tài liệu tham khảo, video học, hoặc các nguồn tài liệu trực tuyến uy tín để nắm vững kiến thức về bảng tuần hoàn.
Việc học bảng tuần hoàn hóa học đòi hỏi sự cố gắng và phương pháp học phù hợp. Bằng việc áp dụng các mẹo mà Hoc2K đã đề cập ở trên, bạn sẽ có khả năng thuộc lòng bảng tuần hoàn một cách dễ dàng và hiệu quả.
Người sáng tạo Bảng tuần hoàn hóa học là ai?
Bảng tuần hoàn hóa học được phát triển bởi nhà hóa học người Nga là Dmitri Mendeleev vào những năm 1860. Ông đã nhận ra rằng có một mô hình tương quan giữa các nguyên tố hóa học và đã xây dựng Bảng tuần hoàn dựa trên sự tăng dần của khối lượng nguyên tử. Ngày nay, nhiều người vẫn gọi là Bảng tuần hoàn hóa học Mendeleev để tưởng nhớ đến người phát triển ra nó.

Bảng tuần hoàn có tác dụng gì?
Một trong những giá trị quan trọng của bảng tuần hoàn là khả năng dự đoán các đặc tính hóa học của các nguyên tố dựa trên vị trí của chúng trên bảng. Các nguyên tố có các thuộc tính khác nhau khi xem xét theo chiều dọc theo các cột hoặc theo chiều ngang theo các hàng trên bảng. Bảng tuần hoàn hóa học không chỉ được áp dụng rộng rãi trong lĩnh vực hóa học, mà còn có ứng dụng trong vật lý, kỹ thuật, công nghiệp và sinh học. Hiểu biết về bảng tuần hoàn hóa học là một kiến thức cơ bản đầu tiên cho những người mới học hóa học.
Lời kết
Tổng quát lại, bảng tuần hoàn hóa học là một công cụ hữu ích giúp học sinh hiểu rõ về các nguyên tố hóa học và quy tắc của chúng. Nắm vững bảng tuần hoàn hóa học sẽ giúp học sinh phát triển khả năng phân tích, dự đoán và giải thích các hiện tượng hóa học, từ đó nâng cao sự hiểu biết và thành tựu trong môn học này. Hi vọng bài viết này của Hoc2K sẽ giúp các bạn học sinh có thể hiểu rõ hơn về bảng tuần hoàn hóa học trong môn hóa học này.
User Rating: ( vote)







